Introdução
Alopecia é definida pela perda temporária ou definitiva, senil ou prematura, total ou parcial, de pelos e/ou cabelos, podendo ser congênita ou adquirida. É classificada em cicatricial (dano permanente e irreversível do folículo piloso) ou não cicatricial (dano temporário e reversível do folículo)(1-4). Apresenta etiologia variada: autoimune, psicológica, genética, traumática, pós-quimioterapia, por dermatite (seborreica, fúngica), eflúvio telógeno, doenças/síndromes sistêmicas(2-4). É de grande prevalência mundial, atingindo a maioria das faixas etárias, sendo mais prevalente na população adulta.
A alopecia infantil é uma doença rara na prática ambulatorial da dermatologia pediátrica1. Estudos mostram que na faixa etária infantil a ocorrência de alopecia representa 1% das consultas dermatológicas. Em 90% dos casos a alopecia de maior incidência é a cicatricial e adquirida, sendo a de etiologia fúngica a mais comum, seguida das de origem multifatorial com componentes autoimunes, genéticos, ambientais e psicossomáticas(1-3).
As apresentações clínicas dos distúrbios capilares em pediatria variam de sutis a desfigurantes, com padrões diferentes dos vistos em adultos. A abordagem e avaliação de paciente com alopecia é altamente dependente de sua idade. As ocorrências destes problemas durante a infância acarretam alterações na autoestima, causando grande estresse emocional para toda família(3,5).
Este relato de caso tem como objetivo descrever a incomum associação entre a bactéria Serratia marcescens, relatada na literatura como importante agente de infecções do trato respiratório, urinário e gastrointestinal humano(6,7), e caso de alopecia infantil.
Descrição do caso
Paciente sexo feminino, 2 anos e 3 meses de idade, procedente de Cristina, Minas Gerais, encaminhada para ambulatório especializado de dermatologia com quadro de “feridas em couro cabeludo” iniciado há dois meses. A responsável pela menor referiu que as lesões surgiram após quadro de pediculose não tratada, há três meses. As lesões eram inicialmente hiperemiadas e pruriginosas, e evoluíram com crostas, secreção serossanguinolenta e alopecia nas regiões afetadas. Foi tratada inicialmente pelo pediatra na cidade de origem com fluconazol, corticoide sistêmico e tópico sem melhora. Concomitantemente, apresentou sintomas de gastroenterite, cujo tratamento foi amoxicilina/clavulanato (25 + 3,6 mg/kg/dia) por 10 dias. A paciente não apresentava comorbidades. Em casa a família possuía dois cães que se encontravam hígidos.
Ao exame físico dermatológico, apresentava lesões em região biparietal do couro cabeludo, aspecto exulcerado associado a crostas, secreção serossanguinolenta, purulenta com alopecia local. Clinicamente, apresentava-se febril (38,5 ºC), com queda no estado geral (Figura 1A). Diante do aspecto das lesões, as hipóteses diagnósticas de Kérion Celsi e de acometimento bacteriano como agentes etiológicos foram consideradas, sendo iniciado tratamento empírico com griseofulvina 25 mg/Kg/dia, azitromicina 10 mg/kg/dia por três dias (pela presença de secreção purulenta com hipótese inicial de colonização por Staphiloccocus aureus) e xampu com antifúngico cetoconazol 2% e antibiótico eritromicina 1% três vezes por semana pelo período de um mês.
Após 11 dias em uso das medicações, paciente evoluiu com piora do quadro, apresentando aumento das lesões.Permanecia febril e com queda do estado geral. Foram solicitados exames laboratoriais como hemograma, glicemia, fator antinúcleo (FAN), anticorpo anti-DNA nativo, cultura da secreção e biópsia das lesões para investigar diagnósticos diferenciais, como o lúpus eritematoso.
Não foi observado leucocitose e as provas reumatológicas (FAN, Anticorpo anti-DNA nativo) apresentaram-se negativas. Não houve crescimento fúngico nas culturas, porém houve crescimento isolado da bactéria S. marcescens. O antibiograma apresentou sensibilidade para gentamicina, levofloxacina e sulfametoxazol/trimetropim.
Iniciado tratamento com antibiótico (sulfametoxazol/trimetoprim, dose 30 + 6 mg/kg/dia por 10 dias) com interrupção de toda medicação anteriormente prescrita. Após duas semanas, a paciente apresentava-se afebril, com melhora do estado geral, sem secreções no couro cabeludo. Dois meses após avaliação dermatológica inicial, retornou com resolução do quadro infeccioso e início da repilação em área de alopecia, apresentando posteriormente repilação quase total do couro cabeludo, com pequenas áreas de alopecia cicatricial (Figuras 1A a C).
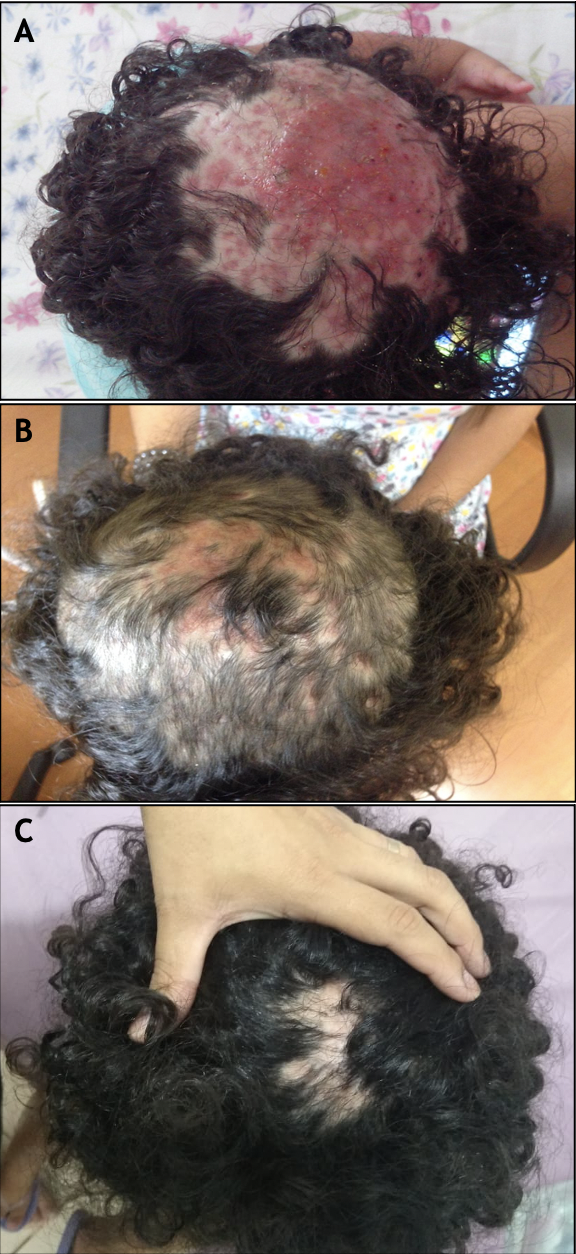
Discussão
A tinea capitis é a dermatofitose mais comum em crianças. Apresenta variações clínicas que vão desde descamação não inflamatória até severa erupção pustular(4,8,9). O Kérion Celsi, por sua vez, é uma complicação grave da dermatofitose, secundária à resposta imune exacerbada à infecção fúngica10. Caracteriza-se por placa inflamatória, bem delimitada, dolorosa, com pústulas e abcessos com tendência supurativa, de forma a promover a expulsão dos pelos parasitados. Como consequência, na sua resolução formam-se áreas cicatriciais fibróticas que podem condicionar zonas de alopecia definitiva(8,9,11).
No caso relatado, a paciente apresentava quadro clínico semelhante. Considerando que as alopecias de etiologia fúngica são as mais comuns, foi realizado tratamento empírico com fármaco de primeira linha – griseofulvina(4,8,11) – para a doença descrita. Porém, a terapia se mostrou ineficaz diante da piora do quadro, afastando a hipótese inicial. Somente após a biópsia da lesão (que foi conclusiva para achados de processo inflamatório com evidências de reação granulomatosa), cultura e antibiograma da secreção local (crescimento isolado de S. marcescens) e demais exames laboratoriais, foi aventada hipótese de infecção bacteriana. Uma vez que a cultura é o exame mais sensível e confiável para a identificação do agente causal da tinea capitis(9,12) e que o tratamento de primeira escolha foi ineficaz, a hipótese de etiologia fúngica como mantenedora do quadro foi definitivamente descartada e a hipótese de infecção bacteriana, confirmada. A griseofulvina é a medicação de escolha no quadro de Kerium Celsi e deve ser utilizada por 1 a 4 meses nos tratamentos de tinea capitis. Devido a piora do estado geral da criança e das lesões, optou-se pela suspensão da medicação e troca dos remédios pelo antibiótico a qual a bactéria era sensível.
No entanto a incidência de infecções por S. marcescens é baixíssima, ocorrendo majoritariamente em pacientes imunossuprimidos e quase nunca em pacientes imunocompetentes, sendo escassos relatos sobre pacientes hígidos acometidos pela bactéria(13-16). Casos de infecções cutâneas foram relatados, nos quais traumatismo anterior, mordidas de animais ou a presença de úlceras foram apontados como facilitadores, atuando como porta de entrada para S. marcescens(14,15,17).
A S. marcescens foi relatada como importante agente colonizadora do trato gastrointestinal, respiratório e geniturinário, podendo causar infecções oportunistas, septicemia e endocardite, nosocomiais ou comunitárias. Infecções cutâneas raramente são relatadas(6,14,15,18,19). Em relato de caso recentemente publicado, foi descrita infecção cutânea facial após injeção de ácido hialurônico em paciente imunocompetente, sendo o trauma cutâneo e falta de higiene fatores determinantes nas causas da infecção(17). De forma similar, no caso descrito, o quadro de gastroenterite prévio sugere a hipótese de autocontaminação do couro cabeludo, uma vez que a bactéria é considerada saprófita do sistema digestivo.
Esse relato evidenciou um quadro dermatológico atípico, dificultando a eficácia terapêutica de início rápido. Entretando, após identificar o patógeno, foi possível introduzir o tratamento correto, auxiliando no prognóstico favorável da paciente.
Conclusão
Há a necessidade de investigação cuidadosa dos casos de alopecia com suspeita de Kérion Celsi que são refratários ao tratamento convencional. Os casos de acometimento bacteriano secundário como possível etiologia são raros, sendo fundamental a realização de exames complementares para confirmação diagnóstica e aceleração do tratamento.
Referências
-
Cortés GA, Mardones VF, Zemelman DV. Caracterización de las causas de alopecia infantil. Rev Chil Pediatr. 2015; 86(4):264-9. doi: 10.1016/j.rchipe.2015.06.015
-
Alves R, Grimalt R. Hair loss in children. Curr Probl Dermatol. 2015;47:55–66. doi: 10.1159/000369405
-
Castelo-Soccio, L. Diagnosis and management of alopecia in children. Pediatr Clin North Am. 2014;61(2):427–42. doi: 10.1016/j.pcl.2013.12.002
-
Xu L, Liu KX, Senna MM. A practical approach to the diagnosis and management of hair loss in children and adolescents. Front Med (Lausanne). 2017;4:112. doi: 10.3389/fmed.2017.00112
-
Goldberg LJ., Castelo-Soccio LA. Alopecia: Kids are not just little people. Clin Dermatol. 2015;33(6):622–30. doi: 10.1016/j.clindermatol.2015.09.005
-
Yu VL. Serratia marcescens: Historical perspective and clinical review. N Engl J Med. 1979;300(16):887–93. doi: 10.1056/nejm197904193001604
-
Cristina ML, Sartini M, Spagnolo AM. Serratia marcescens Infections in Neonatal Intensive Care Units (NICUs). Int J Environ Res Public Health. 2019;16(4):610. doi:10.3390/ijerph16040610
-
Anahory B, Santos P, Borges M. Querion do couro cabeludo – A propósito de um caso clínico. Rev Port Med Geral Fam [Internet]. 2013 [cited 2020 Feb 26];29(6):394-7. Available from: www.scielo.mec.pt/scielo.php?script=sci_arttext&pid=S2182-51732013000600007
-
Ferreira SS, Teixeira C, Machado S, Marques L. Kérion celsi: uma complicação rara da Tinea capitis. Nascer Crescer [Internet]. 2017 [cited 2019 Feb 25];26(2):126-8. Available from: www.scielo.mec.pt/scielo.php?script=sci_arttext&pid=S0872-07542017000200008&lng=pt
-
Mendes GM, Freitas BAC, Oliveira JRL, Cardoso MF, Pacheco EC, Vitória HHM. Kerion celsi: Um relato de caso. Resid Pediatr. 2019;9(1):66-69. doi: 10.25060/residpediatr-2019.v9n1-10
-
Melo-Monteiro C, Martins CJ, Monteiro CS, Paiva MM, Fagundes RO. Kerion Celsi por Microsporum gypseum. An Bras Dermatol. 2003;78(3):319-21. doi: 10.1590/S0365-05962003000300008
-
Peixoto AB, Novis CFL, Vilela GM, Lerer C. Kerion: a importância da sua diferenciação com infecção bacteriana do couro cabeludo. Relato de caso. Rev Soc Bras Clín Méd. 2012;10(3):243-5.
-
Karkey A, Joshi N, Chalise S, Joshi S, Shrestha S, Thi Nguyen TN, Dongol S, Basnyat B, Baker S, Boinett CJ. Outbreaks of Serratia marcescens and Serratia rubidaea bacteremia in a central Kathmandu hospital following the 2015 earthquakes. Trans R Soc Trop Med Hyg. 2018;112(10):467-472. doi: 10.1093/trstmh/try077
-
Giraldez, PE, Mayo PP, Losada A. Skin infection due to Serratia marcescens in an immunocompetent patient [Article in Spanish]. Actas Dermosifiliogr. 2011;102(3):236–7. doi: 10.1016/j.ad.2010.07.008
-
Diranzo JG, Villodre JJ, Zarzuela VS, Castillo LR, Bru AP. Skin Abscess due to Serratia marcescens in an Immunocompetent Patient after Receiving a Tattoo. Case Rep Infec Dis. 2015;2015:626917. doi: 10.1155/2015/626917
-
Rodrıguez GF, Paz RC, Gonzalez RS. Cutaneous infection caused by Serratia marcescens in a child. J Am Acad Dermatol. 2006;55(2):357–8. doi: 10.1016/j.jaad.2005.08.053
-
Park KY, Seo SJ. Cutaneous Serratia marcescens infection in an immunocompetent patient after filler injection. Acta Derm Venereol; 2013;93(2):191–2. doi: 10.2340/00015555-1362
-
Rodríguez-Palacios MM, Takahasi-Álvarez V, Vega-Bogado ME. Caracterización clínica y epidemiológica de brote a Serratia marcescens en una Unidad de Cuidado Intensivo Pediátrico Hospital Nacional de Itaugua. Paraguay. Abril a setiembre 2015. Rev Nac (Itauguá). 2016;8(2):19-33. doi: 10.18004/rdn2016.0008.02.019-033
-
Pérez Morales L, Valdivia Portales Y, Torres Morel A. Aislamiento de Serratia marcescens en herida quirúrgica. Medisur [Internet]. 2017 [cited 2020 Jul 08];15(4):538-44. Avaiable from: scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1727-897X2017000400013&lng=es